Ferngesteuert mit Licht
Die Optogenetik revolutioniert die Labors von Grundlagenforschung und Industrie. Mit ihr lassen sich Nervenzellen gezielt von außen steuern.
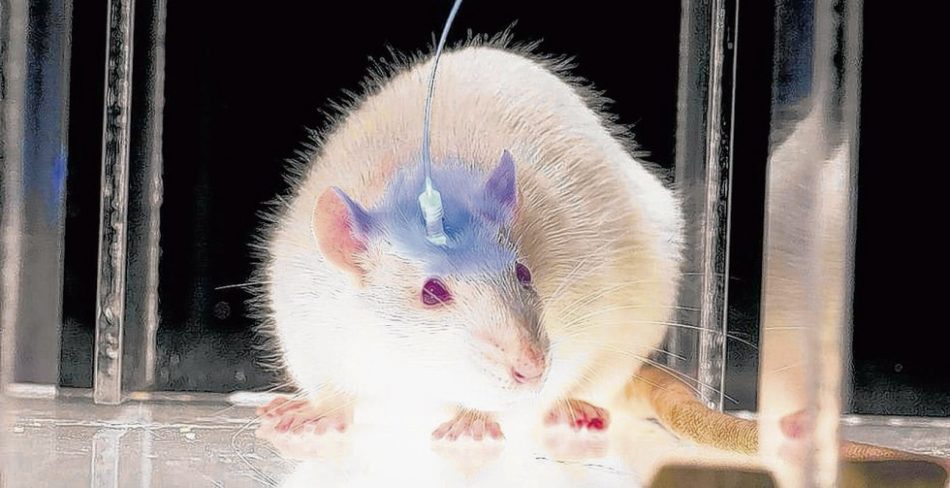
Foto: Karl Deisseroth/Stanford University
Laser an – und die brave Maus im Käfig stürzt sich plötzlich auf alles in ihrer Nähe. Laser aus – und „Rambo“ ist wieder ein putziger kleiner Nager. Mit diesem Experiment zur Optogenetik zeigten US-Forscher der Yale University erstmals, dass neuronale Schaltkreise im Gehirn gezielt mit Licht angesteuert werden können.
Zugleich gelang so der Nachweis, dass der Jagdtrieb der Tiere in einer speziellen Hirnstruktur, der Amygdala, sitzt. Dieses emotionale Zentrum ist auch beim Menschen ausgebildet. Es gilt als Zielstruktur für neue Medikamente gegen Ängste.
Der genetische Bauplan für den Lichtschalter per Virentransfer eingeschleust
Damit sich Nervenzellen durch Lichtsignale von außen kontrollieren lassen, müssen sie gentechnisch verändert werden. Per Virentransfer erhalten sie den genetischen Bauplan für den Lichtschalter sowie für ein weiteres Gen, das nur in den gewünschten Nervenzellen abgelesen wird. Ein- und ausgeschaltet wird er über eine Glasfaser, die das Licht ins Gehirn der Versuchstiere leitet.
Der Schalter ist ein lichtempfindliches Protein, das Kanalrhodopsin. Es wirkt wie ein Fotorezeptor, mit dem fotosynthesetreibende Mikroorganismen den Weg zum Licht finden. Rhodopsine kommen auch im menschlichen Auge vor. Sie sitzen in den Lichtsinneszellen, wo sie Licht in elektrische Signale umwandeln und so das Sehen ermöglichen.
Erster Ansatz, erblindete Menschen zu behandeln
Mittlerweile gibt es künstliche Varianten des Proteins: für blaues, gelbes und grünes Licht, hochempfindliche für bestimmte Wellenlängen oder weniger empfindliche, schnell und langsam reagierende Rhodopsine. Derzeit erobern die 2003 von einer Gruppe um Peter Hegemann und Ernst Bamberg am Max-Planck-Institut für Biophysik in Frankfurt entdeckten Rhodopsine die Medizin.
Erblindete Menschen sollen damit wieder soweit sehen können, dass sie im Alltag ohne fremde Hilfe zurechtkommen, so das Ziel von Retrosense. Das Unternehmen in San Francisco erprobt den optogenetischen Ansatz derzeit in klinischen Studien an Patienten mit Retinitis pigmentosa. Bei diesem Leiden sind die Lichtsinneszellen in der Netzhaut der Augen von einem fortschreitenden Zerfall betroffen, der schließlich zur Erblindung führt.
Gen für Kanalrhodopsin in die Nervenzellen der Netzhaut
„Wir haben Viren genetisch so abgeändert, dass sie in die Nervenzellen der Netzhaut ein Gen für ein Kanalrhodopsin einschleusen“, sagt Zhuo-Hua Pan von der Wayne State University in Detroit. Der Plan des Beraters von Retrosense: die Nervenzellen in funktionsfähige Lichtsinneszellen umzubauen. Das ist dem Forscher bereits 2008 bei erblindeten Mäusen gelungen. Nachdem ihnen unter Narkose die Viren ins Auge gespritzt wurden, reagierten sie auf Hell-Dunkel-Reize und konnten sich grob orientieren.
Für die Anwendung beim Menschen sind die Hürden hoch. Sicherheit und Unbedenklichkeit der Therapie müssen ebenso bestätigt werden wie der Nachweis der Wirksamkeit. Medien in den USA berichten über erste Erfolge. So soll sich bei einigen Patienten die Sehkraft deutlich verbessert haben.
Pharmaunternehmen nutzen Optogenetik für die Suche nach neuen Medikamenten
Auch die Pharmaindustrie interessiert sich für die Optogenetik. Die hochpräzisen Lichtschalter sollen die automatisierte Suche nach neuen Medikamenten optimieren und beim sogenannten Hochdurchsatz-Screening schnelle und zuverlässige Ergebnisse liefern. Das erprobt derzeit der Pharmakonzern Bayer. Getestet wird die Wirkung bestimmter Substanzen auf einzelne Zellen, die in winzig kleinen Reaktionsgefäßen schwimmen. Das Problem dabei: Manche der Zellen sind in einem aktiven, andere in einem passiven Zustand. Die Bindung mit der Testsubstanz erfolgt meist nur im aktiven Zustand. Um in die Zelle zu gelangen, nutzt die Wirksubstanz Ionenkanäle. Das sind Proteine, die wie eine Pore in der Zellmembran sitzen und Durchlass gewähren, wenn sie aktiviert werden.
Genau das ermöglichen optogenetische Schalter. Lichtimpulse aktivieren die Ionenkanäle innerhalb von tausendstel Sekunden. Treffer, die einen vielversprechenden Medikamentenkandidaten verraten, sind nun eindeutig erkennbar. Eine Indikatorsubstanz wandelt sie in ein Leuchtsignal um, das eine Kamera automatisch auswertet. Noch laufen Tests mit der neuen Technik. Erste Ergebnisse seien recht positiv ausgefallen, heißt es bei Bayer. Nun will man das optogenetische Hochdurchsatz-Screening zügig zur Anwendung bringen.