Künstlicher Kreislauf schützt Spenderherz in der Transportbox
Bei einer Transplantation muss es schnell gehen, damit das Gewebe im Spenderorgan nicht zugrunde geht. Eine neue Transportbox mit Kreislaufpumpe und Oxygenator schützt Herzen jetzt über längere Zeit. Das vergrößert auch den Radius des möglichen Empfängerkreises wesentlich.
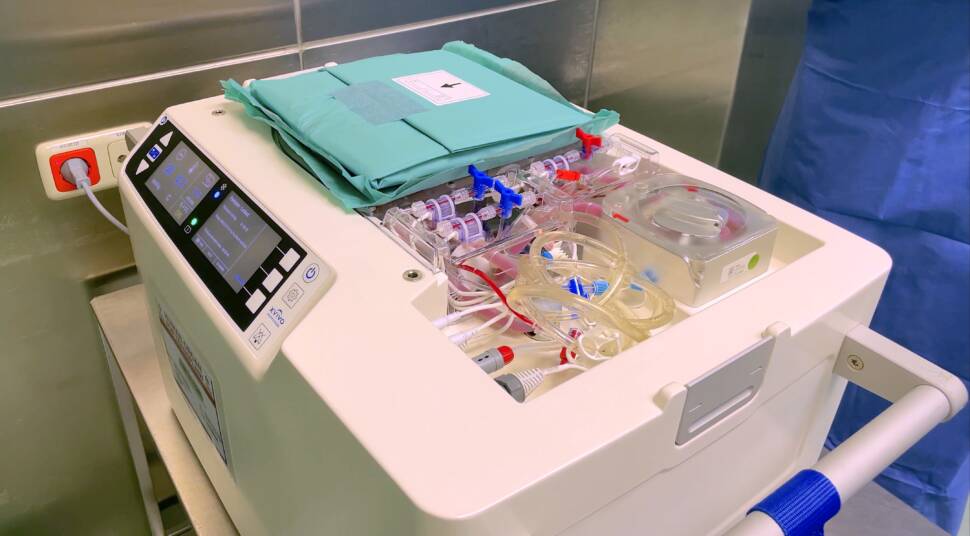
Foto: DHZC
Inhaltsverzeichnis
Eine Organtransplantation ist für die Medizin eine echte Herausforderung. Zum einen muss eine passende Spende gefunden werden, zum anderen muss das Organ so behandelt werden, dass das Gewebe auf dem Weg zum Empfänger keinen Schaden nimmt. Was schon schwierig genug ist, denn die Durchblutung – und damit eine Versorgung mit Sauerstoff und Nährstoffen – hört ja mit dem Tod des Spenders unmittelbar auf.
Besonders kritisch ist das beim Herzen, dessen Gewebe besonders empfindlich darauf reagiert. Etwa vier Stunden, die sogenannte Ischämiezeit, räumen Fachleute ein als sicheren Zeitraum zwischen Entnahme und Einpflanzung eines Herzens ein. Was den möglichen Empfängerkreis ziemlich einschränkt. Lange Transportwege sind dann nicht möglich.
Kühlsystem mit Kreislaufpumpe für das Spenderherz
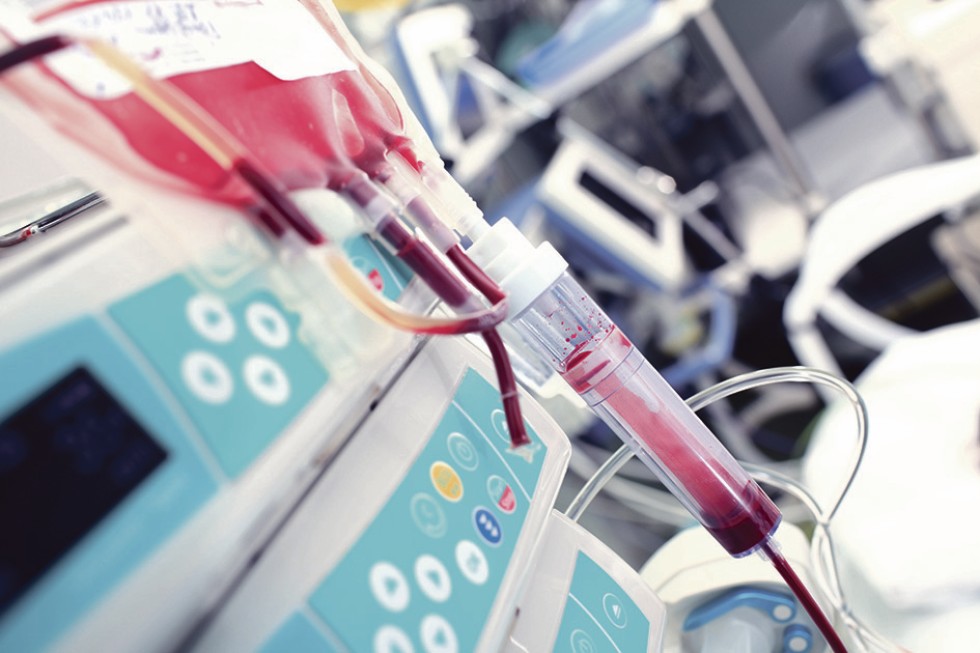
Bisher übliche Praxis ist es, das Herz mit einer konservierenden Lösung bei 4 °C zu spülen und in eine Kühlbox zu legen. Nun aber haben schwedische Forschende eine neue Methode zur Konservierung von Spenderherzen entwickelt. Die „hypothermisch oxygenierte Maschinenperfusion“ (Hope) funktioniert praktisch wie ein künstliches Kreislaufsystem in der Transportbox, denn das mit einer speziellen Konservierungslösung arbeitende Gerät – kaum größer als ein Umzugskarton – enthält ein Kühlsystem, eine Kreislaufpumpe und einen Oxygenator.
Im Gerät befindet sich die Nähr- und Konservierungslösung. Sie besteht unter anderem aus roten Blutkörperchen, Hormonen, Proteinen und Humanalbumin. Das Organ wird direkt nach der Entnahme aus dem Körper des Verstorbenen an die Kreislaufpumpe angeschlossen und während des Transports kontinuierlich mit der Lösung durchspült. Der integrierte Oxygenator versorgt dabei die Herzmuskelzellen permanent mit frischem Sauerstoff. Das Ganze findet bei konstant 8 °C statt, um den Stoffwechsel möglichst gering zu halten.
Wie die Kühlbox während einer Herztransplantation eingesetzt wird, zeigt folgendes Video.
Hier wird Ihnen ein externer Inhalt von youtube.com angezeigt.
Mit der Nutzung des Inhalts stimmen Sie der Datenschutzerklärung
von youtube.com zu.
44 % weniger schwerwiegende Ereignisse nach Herztransplantation
In einer internationalen Studie wurde das für den Menschen zugelassene System nun getestet. Daran beteiligt war auch das Deutsche Herzzentrum der Charité (DHZC) in Berlin, das das System als erste Klinik in Deutschland ausprobierte. Insgesamt erhielten im Rahmen der Studie, deren Ergebnisse jetzt in der Fachzeitschrift „The Lancet“ veröffentlicht wurden, 204 Männer und Frauen eine Herztransplantation.
Untersucht wurde, ob innerhalb von 30 Tagen nach der Transplantation eine primäre Transplantatdysfunktion, vereinfacht gesagt eine mangelhafte Funktion des Spenderorgans unmittelbar nach der Transplantation, eine akute zelluläre Abstoßung, ein Transplantatversagen oder gar der Tod der Patientin oder des Patienten auftrat. Diese schwerwiegenden Ereignisse traten bei nur 19 % der behandelten Personen auf im Gegensatz zu 30 % bei einer üblichen Herztransplantation, was einer Verringerung des Risikos von 44 % bedeutet.
Spenderorgane ohne Schädigung länger transportieren
„Die Möglichkeit, Spenderorgane ohne Schädigung über deutlich längere Zeiträume zu transportieren, könnte die Anzahl der für unsere Patientinnen und Patienten auf der Warteliste infrage kommenden Spenderorgane erheblich steigern“, ist Herzchirurg Christoph Knosalla überzeugt. Er ist chirurgischer Leiter des Transplantationsprogramms am DHZC und einer der Autoren der Studie. Und: Man könnte Organe annehmen, die bisher abgelehnt werden mussten, weil sie auch kürzere Transporte ohne Sauerstoffzufuhr aufgrund verschiedener Umstände nicht unbeschadet überstehen würden.