VDE: Marktzugang für lernende KI in der Medizin gefordert
Viele Medizinprodukte arbeiten bereits mit Künstlicher Intelligenz. Für Systeme mit lernender KI fordert der Technologieverband VDE nun Verbesserungen beim Marktzugang.

Foto: PantherMedia / merrydolla
Von Bettina Reckter
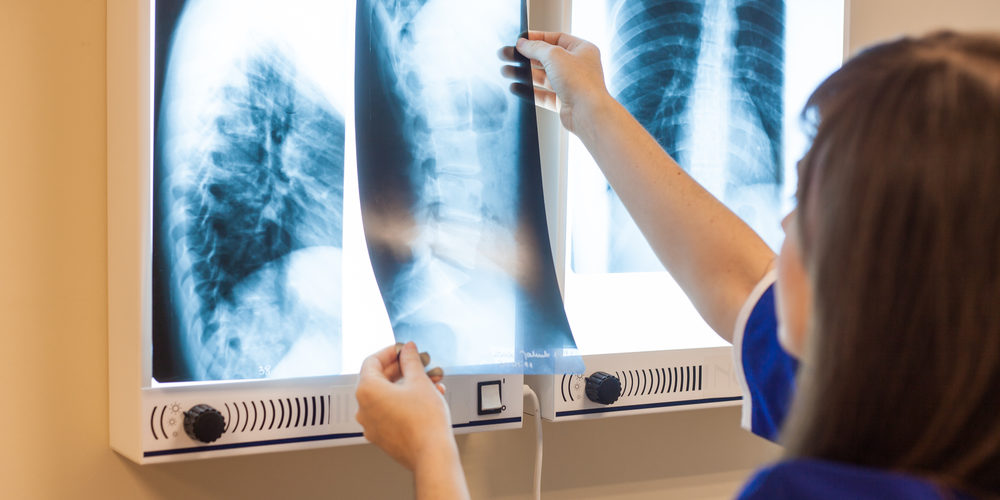
Sie werten bergeweise Bilddaten von CT- oder MRT-Scans aus und unterstützen Ärzte bei der Diagnose. Sie helfen sogar bei der Behandlung, indem sie anhand von Analysen der Patientendaten vorhersagen, wie gut eine Therapie anschlagen wird: In der Medizin haben Systeme mit Künstlicher Intelligenz ein vielseitiges Anwendungspotenzial.
Aus diesem Grund wächst der Markt von KI-Systemen als Medizinprodukt in Europa und den USA in den vergangenen Jahren kontinuierlich. Allerdings sind dies meist sogenannte statische KI-Systeme. Das heißt, bei ihnen ist der Lernprozess bereits vor der Inbetriebnahme abgeschlossen, das zugrunde liegende KI-Modell darf sich nicht mehr ändern.
Innerhalb der EU dürfen lernende KI-Systeme bisher nicht vermarktet werden
Kontinuierlich-lernende KI-Systeme hingegen haben keinen festgelegten technischen Entwicklungsstand. Sie werden in der Marktphase immer weiter mit neuen Daten trainiert. Dies verbessert auch die Leistung des KI-Modells. Allerdings dürfen solche Anwendungen innerhalb der EU zurzeit nicht in Verkehr gebracht und vermarktet werden.
Lesetipp: KI in der Medizin – Gesundheitsminister Lauterbach warnt vor Missbrauch
Diese innovationshemmende Vorgehensweise will die Deutsche Gesellschaft für Biomedizinische Technik (DGBMT) im VDE nun ändern. Die Expertinnen und Experten haben dafür das europäische Regelwerk analysiert und mit bereits existierenden Vorschlägen für einen neuen regulatorischen Rahmen abgeglichen. Auch der zukünftige europäische Artificial Intelligence Act (AIA) ist in die Empfehlung eingeflossen: Kernstück bildet eine sogenannte „antizipierende CE-Konformitätsbewertung“, die die Planung und Genehmigung von beabsichtigten Änderungen bereits vor der Inbetriebnahme vorsieht.
CE-Kennzeichnung als antizipierende Konformitätsbewertung für Medizinprodukte mit lernender KI
Die Hersteller von Medizinprodukten müssen vor dem Inverkehrbringen die Konformität ihrer Geräte mit den Anforderungen der Medical Device Regulation (MDR) oder der In vitro Diagnostic Regulation (IVDR) nachweisen. Ist das Verfahren der Konformitätsbewertung abgeschlossen, stellen die Unternehmen eine EU-Konformitätserklärung aus und versehen das Produkt mit einer entsprechenden CE-Kennzeichnung.
Lesetipp: Digitale Gesundheits-ID soll die Versichertenkarte ersetzen
Für Medizinprodukte mit zugrunde liegender lernender KI wäre deshalb eine antizipierende CE-Konformitätsbewertung sinnvoll. Sie wäre dadurch gekennzeichnet, dass diese vorgreifend, unter Einschluss der beabsichtigten Änderungen, im Laufe der Inbetriebnahme erfolgt. Für spätere Änderungen, die sich im Rahmen des Genehmigten bewegen, könnte von einer weiteren Genehmigung durch die Benannten Stellen abgesehen werden. Änderungen, die nicht vorhersehbar und denknotwendig nicht antizipiert werden können, wären dann einem erneuten Konformitätsbewertungsverfahren zu unterziehen und nachträglich zu zertifizieren.